10 دقیقه
حبابهای نامرئی و نانومتری که از سلولها آزاد میشوند، بهعنوان بازیگران کلیدی در چگونگی انتقال سرطان در سراسر بدن پدیدار شدهاند. با بازتولید این پیامرسانهای بسیار کوچک در آزمایشگاه، پژوهشگران امیدوارند هم مسیرهای متاستاز را نقشهبرداری کنند و هم داروها را با دقت بیشتر به تومورها برسانند — کاری که میتواند پیشروی سرطان را متوقف کند یا بهطور قابلملاحظهای کند نماید. این حوزه تحقیقاتی در تقاطع نانوپزشکی، زیستمهندسی و بیولوژی سرطان قرار دارد و پتانسیل بالایی برای توسعه درمانهای هدفمند و تشخیصهای زودهنگام نشان میدهد.
این حبابهای کوچک چه هستند و چرا اهمیت دارند
هر سلول وزیکلهای خارج سلولی (extracellular vesicles) ترشح میکند — ذراتی پوشیده شده با غشا که اغلب کمتر از 100 نانومتر قطر دارند و لیپیدها، پروتئینها و بخشهایی از مواد ژنتیکی را حمل میکنند. در زیستشناسی سالم، این وزیکلها نقش ترابری پیام بین سلولها را بر عهده دارند. اما در سرطان، این وزیکلها میتوانند بهعنوان پیکهای پنهانی عمل کنند که با آمادهسازی بافتهای دورافتاده، بازسازی میکرومحیطها و حتی بازبرنامهریزی سلولهای سالم به نفع رشد تومور کمک میکنند. این زنجیره از رویدادها بخش محوری متاستاز است؛ فرایندی که طی آن سرطان از تومور اولیه به اعضایی مانند کبد یا ریه سرایت میکند.
درک ترکیب مولکولی و مسیر ترافیکی این وزیکلها ضروری است. اما جداسازی و شناسایی وزیکلهای خارج سلولی طبیعی از خون یا بافت، فرآیندی کند، فنی و متغیر است که به ابزارها و استانداردهای دقیق نیاز دارد. همین گلوگاه باعث شده تیمهای زیستمهندسی و زیستشناسی سرطان به سمت همتایان مصنوعی روی بیاورند: لیپوزومها و دیگر نانوذرات لیپیدی که شکل و عملکرد وزیکلهای طبیعی را تقلید میکنند و امکان تولید قابلتکرار و کنترلشده را فراهم میآورند.
چگونه پژوهشگران پیامرسانهای سرطان را بازتولید میکنند
در مدرسهٔ عالی فناوری (ÉTS)، یک گروه میانرشتهای به رهبری مهندسان، لیپوزومها را با استفاده از میکسِرهای میکروفلوئیدیک (micromixers) مهندسی میکند — دستگاههای میکروفلوئیدیک که بهسرعت محلولهای لیپیدی، پروتئینی، آبی و الکلی را ترکیب میکنند تا نانوذرات یکنواختی شکل بگیرند. با تنظیم نسبت لیپیدها، بار سطحی و محتوای پروتئینی، آزمایشگاه ذراتی تولید میکند که از نظر اندازه و رفتار به وزیکلهای خارج سلولی طبیعی شبیهاند. این رویکرد اجازه میدهد پارامترهای فیزیکوشیمیایی مانند سایز هیدرودینامیک، پتانسیل زتا و نماهای سطحی پروتئینی را به دقت کنترل کنند.
این وزیکلهای مصنوعی با نشانگرهای فلورسنتی برچسبگذاری میشوند، با سلولهای سرطانی کشتشده انکوبه میگردند و بهصورت زمان-واقعی تصویربرداری میشوند. آزمایشها میزان و سرعت جذب جمعیت نانوذرات توسط سلولها را دنبال میکنند و مشخص میسازند کدام ویژگیهای بیوشیمیایی جذب را افزایش میدهند. بهاختصار، هر چه اندازه، بار سطحی و پروتئینهای سطحی لیپوزوم به وزیکل طبیعی نزدیکتر باشد، احتمال جذب توسط سلول سرطانی بیشتر میشود. این نتایج اهمیت کلیدی پارامترهای فیزیکی در تعیین مسیر و کارایی انتقال پیام را نشان میدهد.
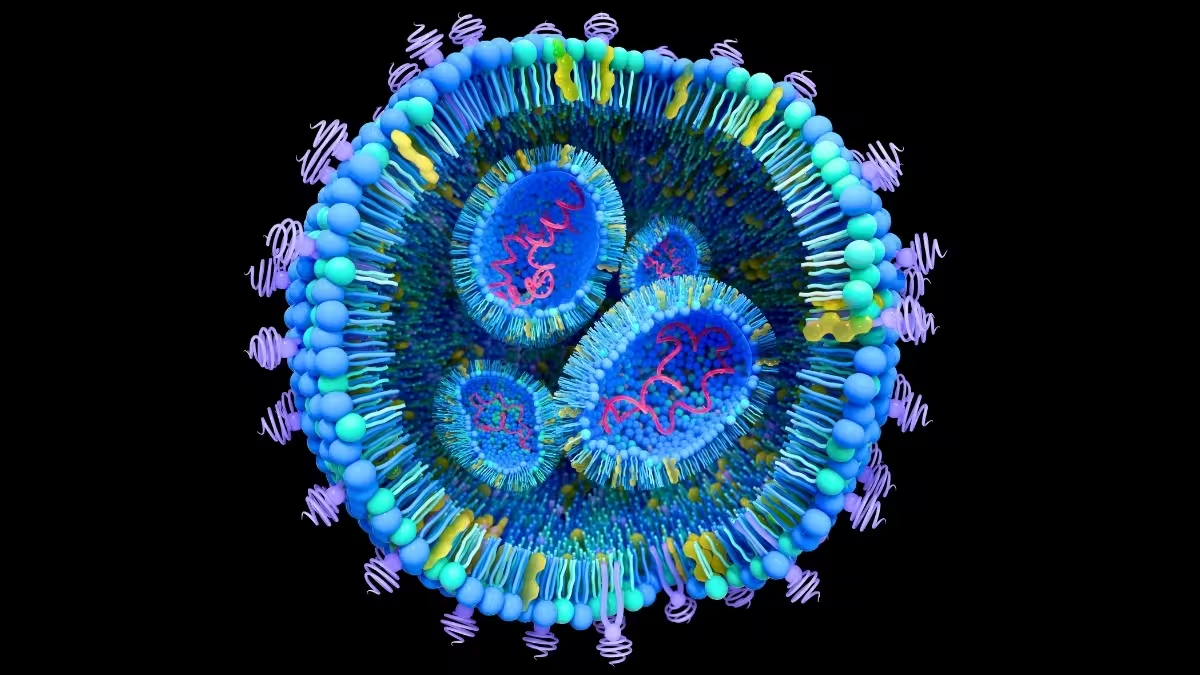
این وفاداری در دو جنبه اهمیت دارد. اول، یک تقلید دقیق کمک میکند تا دانشمندان مسیرهایی را که وزیکلهای مشتق از تومور به اندامهای خاص طی میکنند و پیامهایی که به سلولهای میزبان میفرستند، نقشهبرداری کنند. دوم، این امر راهی برای استفاده از همان حاملها بهعنوان شاتلهای دارویی هدفمند باز میکند — یعنی تبدیل یک پدیده بیماریزا به پلتفرمی برای تحویل هدفمند دارو. در هر دو مورد، مفاهیم کلیدی شامل تبيین نقش وزیکلها در متاستاز، طراحی نانوذرات لیپیدی با بار سطحی و سایز مناسب و مهندسی پوششهای پروتئینی برای انتخابپذیری است.
از مدلهای آزمایشگاهی تا ایدههای درمانی
کار فعلی به بازدهی حدود ~50% برای محصورسازی پروتئینها داخل لیپوزومهای ساخت آزمایشگاه رسیده است؛ هدف تیم این است که این رقم را به سمت 90% سوق دهد تا بهتر با وزیکلهای خارج سلولی طبیعی تطابق پیدا کند. افزایش بازدهی محصورسازی پروتئین، نه تنها به شبیهسازی دقیقتر عملکرد بیولوژیک کمک میکند، بلکه امکان بارگذاری مؤثر مولکولهای درمانی حساس را نیز فراهم میآورد. پس از اصلاح پارامترهای فرمولاسیون، پروتکل از کشت سلولی به مدلهای حیوانی منتقل میشود — مطالعات برنامهریزیشده روی موش یا رت که انتقال و تحویل بار درمانی در شرایط in vivo را تایید کنند.
چندین استراتژی درمانی در حال بررسی است. یکی از آنها بارگذاری لیپوزومها با داروهای شیمیدرمانی شناختهشده مانند پاکلیتاکسل است، که قبلاً نشان داده هنگام فرمولاسیون در حاملهای لیپیدی، تحویل و تحملپذیری بهبود مییابد. استراتژی دیگر، محصورسازی ترکیبات طبیعی فعال زیستی است: کرکومین (موجود در زردچوبه) و مولکولهای مرتبط در مطالعات متعدد اثرات ضدالتهابی و ضدتکثیری نشان دادهاند و بستهبندی کرکومین در لیپوزومها، زیستدسترسپذیری و قابلیت هدفگیری به تومور را افزایش میدهد.
فراتر از مولکولهای کوچک، لیپوزومها میتوانند نوکلئیک اسیدها یا آنتیبادیها را حمل کنند. قطعات کوتاه DNA، siRNA یا بخشهای آنتیبادی را میتوان به تومورها منتقل کرد تا آنکوژنها خاموش شوند، سلولهای سرطانی به دارو حساستر شوند یا سلولهای بدخیم برای حذف ایمنی نشانهگذاری شوند. این رویکردهای چندمودی هماکنون بخشی از جعبهابزار در حال گسترش نانوپزشکی هستند و در برخی زمینهها به کاربرد بالینی رسیدهاند. یک مزیت مهم این روشها، کاهش سمیت سیستمیک و افزایش تمرکز دارویی در بخشهای پاتولوژیک است که میتواند نتایج بالینی را بهبود بخشد.
آنچه آزمایشها نشان میدهند
تصویربرداری زمان-واقعی نشان میدهد که سایز ذره و شیمی سطحی، تعیینکنندههای اصلی جذب هستند. ذراتی که قطر و نمای الکتروشیمیایی وزیکلهای طبیعی را بازتولید میکنند، در سلولهای سرطان کبد در شرایط in vitro بهتر داخلیسازی میشوند؛ این مشاهدات پیشنهاد میدهد که متاستاز انداممحور ممکن است تا حدی توسط هویت فیزیکی وزیکلهای در گردش میانجیگری شود. به عبارت دیگر، مشخصات فیزیکی وزیکلها — مانند اندازه، شکل و بار سطحی — میتواند نوعی «قفلگذاری فیزیکی» بر توانایی ورود به بافتهای هدف اعمال کند.
این بینش یک پرسش دیرینه در پژوهش متاستاز را بازتعریف میکند: آیا هدفگیری اندام عمدتاً توسط سیگنالهای مولکولی ترشحشده از تومور هدایت میشود، یا سیستمهای تحویل فیزیکی — خود وزیکلها — نقش کنترلکنندهای دارند؟ پاسخ ظاهراً هر دو است. بار بیوشیمیایی، بافت هدف را راهنمایی میکند و صفات فیزیکی وزیکل تعیین میکنند که آیا به میزان کافی به آنجا میرسند یا خیر. این تعامل میان محتوای مولکولی و ویژگیهای فیزیکی حامل، یک چارچوب مفهومی قوی برای طراحی نانوذرات هدفمند ارائه میدهد.
پیامدهای بالینی بالقوه
- پیشگیری از متاستاز: اگر آمادهسازی (priming) اندامهای دوردست توسط وزیکلها مسدود شود، ممکن است هرگز سرطان متاستاتیک مستقر نشود. دامهای مبتنی بر لیپوزوم یا بازدارندهها میتوانند وزیکلهای مضر را قبل از عملکردن رهگیری کنند و شانس تشکیل ضایعات متاستاتیک را کاهش دهند. این رویکرد بهعنوان استراتژی پیشگیرانه در بیماران با خطر بالا میتواند تحولآفرین باشد.
- درمان هدفمند: لیپوزومهایی که برای تقلید وزیکلهای توموری طراحی شدهاند، میتوانند داروهای سیتوتوکسیک یا درمانهای ژنی را بهصورت انتخابی به جایگاههای متاستاتیک برسانند و سمیتی که بهطور سیستمیک رخ میدهد را کاهش دهند. این امر مخصوصاً برای داروهای با پنجره درمانی باریک و سمیت بالا اهمیت دارد.
- بیومارکرها و تشخیص: مشخصهیابی ترکیب وزیکلها در خون ممکن است علائم هشداردهنده زودهنگام خطر متاستاز یا پاسخ درمانی را ارائه دهد. آنالیز پروتئومیک و نوکلئیک وزیکلها میتواند نشانگرهای اختصاصی سرطان و مراحل پیشرفت بیماری را آشکار سازد؛ این دادهها در تشخیص، استیجینگ و پایش درمان مفید خواهند بود.
این اهداف قابلاندازهگیری هستند و نه رؤیاهای دوردست. چندین فرمولاسیون نانو هماکنون در کاربردهای بالینی حضور دارند و مطالعات جاری طراحی ذره را برای افزایش اختصاصیت، کاهش پاکسازی ایمنی و بهینهسازی رهایش بار درمانی پالایش میکنند. همچنین ترکیب دادههای تصویربرداری زمان-واقعی با پروفایل مولکولی وزیکلها میتواند مسیرهای تبدیل سریعتر از آزمایشگاه به کلینیک را هموار سازد.
دیدگاه کارشناسی
"ت reproducing بستههای ارتباطی خود بدن به ما هم میکروسکوپ و هم نقشه میدهد،" میگوید دکتر لنا مارکز، یک مهندس زیستپزشکی فرضی که حاملهای نانو را مطالعه میکند. "وقتی یک لیپوزوم ساختهشده در آزمایشگاه مانند وزیکل مشتقشده از سرطان رفتار میکند، میتوانیم مسیر تحویل را مشاهده کنیم و سپس مداخلاتی طراحی نماییم که یا سیگنالهای مضر را مسدود کنند یا از همان مسیر برای رساندن درمانهای دقیق استفاده کنند."
این دیدگاه ارزش دوگانهٔ این رویکرد را برجسته میسازد: تعمیق دانش بنیادی دربارهٔ متاستاز در حالی که توسعهٔ درمانهای ترجمهپذیر را تسریع میکند. همزمان، این کار نقش مهمی در بهبود جعبهابزار نانوپزشکی ایفا میکند از جمله بهکارگیری تکنیکهای میکروفلوئیدیک، شناسایی نشانگرهای سطحی خاص و طراحی پوششهای پلیمری یا پروتئینی برای کاهش ایمیونوزیته و افزایش نیمهعمر در گردش خون.
چالشها و گامهای بعدی
مانعهای عمدهای همچنان باقی است. مقیاسبندی تولید ذرات یکنواخت، تضمین محصورسازی پایدار پروتئین، جلوگیری از پاکسازی سریع توسط دستگاه ایمنی و تائید ایمنی در مدلهای حیوانی همه حوزههای فعال پژوهشی هستند. مسیرهای مقرراتی برای هیبریدهای پیچیدهٔ بیولوژیک–نانوذرهای نیز هنوز در حال تکاملاند که میتواند ترجمهٔ بالینی را کند سازد. برای مثال، الزامات کیفیت، پایداری و نشانگرهای ایمنی برای نانوفرمولاسیونهای حاوی پروتئین یا اسیدهای نوکلئیک پیچیده است و نیازمند دادههای جامع فارماکولوژیک و توکسیشناسی است.
با این وجود، یافتههای تدریجی گزارششده توسط تیمهای میانرشتهای در حال همگرا شدناند: وزیکلهای خارج سلولی صرفاً پیامدهای فرعی بیماری نیستند بلکه عوامل فعال در پیشرفت سرطاناند. و با کپیبرداری از آنها، پژوهشگران ممکن است اهرمی بهدست آورند تا متاستاز را مؤثرتر پیشگیری یا درمان کنند. مطالعات آتی باید تعاملات بین وزیکلهای توموری و سلولهای ایمنی، نقش میکروبیوم میزبان در تنظیم توزیع وزیکلها و روشهای کمّی برای اندازهگیری بار موثر در بافت هدف را روشن نمایند.
گذر از کشت سلولی به مدلهای حیوانی، برای همکاری ÉTS–McGill، نقطه عطف حیاتی در کوتاهمدت است. اگر این مطالعات موفقیتآمیز باشند، میتوانند راه را برای آزمایشهای انسانی واسط بر روی میراکترکهای مبتنی بر لیپوزوم و سیستمهای تحویل هدفمند هموار کنند — فناوریهایی که ممکن است نتایج را برای بیماران با خطر بالای بیماری متاستاتیک تغییر دهند. در نهایت، تلفیق بیولوژی وزیکلها با مهندسی مواد و طراحی بالینی میتواند به ایجاد راهحلهای تشخیصی و درمانی نوآورانه در سرطان منجر شود.
منبع: sciencealert
نظرات
علی.ف
اگه بتونن 90% محصورسازی رو برسونن، واقعا بازی عوض میشه... ولی مسیر پر از مانعه، عجله نکنید
مهدی
کمتر رمانتیکش کنن! احساس میکنم یه ذره اغراق داره، مخصوصا دربارهی پیشگیری از متاستاز، بازم شواهد حیوانی لازمه
شهرلاین
دیدگاه علمیاش منطقیه، ولی مسیر از آزمایشگاه تا کلینیک طولانیه. باید صبر کنیم و داده ببینیم.
بیونیکس
من تو آزمایشگاه دیدم لیپوزومها رفتار متفاوتی داشتن با پوشش پروتئینی، پیادهسازی توی حیوانات خیلی مهمه، امیدوارم نتایج واقعی باشن
توربوم
سایز و بار سطحی، کلید کاره. معلومه
کوینپیل
این واقعاً قابل اعتماد هست؟ جداسازی وزیکلها از خون که سخت گفته شده، پس چطور میخوان توی آدمی عمل کنن؟
دیتاپالس
وااای، یعنی حبابهای نانومتری میتونن مسیر سرطان رو آماده کنن؟ عالی و ترسناک با هم... کلی سوال تو سرم!

ارسال نظر