8 دقیقه
تزریق سلولهای بنیادی بازگرداننده آسیب سکته مغزی در مغز موشها
پژوهشگرانی از دانشگاه زوریخ و دانشگاه کالیفرنیای جنوبی گزارش دادهاند که سلولهای بنیادی انسانی پیوندی میتوانند بافت مغزی آسیبدیده ناشی از سکته ایسکمیک را در مدلهای موشی ترمیم کنند. در یک مدل پیشبالینی، سلولهای بنیادی تزریقی پس از پیوند زنده ماندند، تکامل یافتند و به سلولهایی شبیه نورون تبدیل شدند و ارتباطاتی با بافت میزبان برقرار کردند. این مطالعه که در نشریه Nature Communications منتشر شده است، پاسخ باززایشی چندوجهی را نشان میدهد: تمایز عصبی، ترمیم عروقی، کاهش التهاب و تقویت یکپارچگی سد خونی-مغزی. این تغییرات همزمان با بهبودهای قابل اندازهگیری در هماهنگی حرکتی حیوانات تحت درمان همراه بود.
پیشزمینه علمی و رویکرد تجربی
سکته مغزی—که ممکن است بهدلیل خونریزی داخلی یا کاهش اکسیژن ناشی از انسداد عروق رخ دهد—باعث مرگ سلولهای مغزی و در بسیاری از موارد ایجاد نقصهای ماندگار در گفتار، حرکت و شناخت میشود. درمانهای فعلی عمدتاً بر کاهش آسیب حاد و توانبخشی تمرکز دارند؛ در حالی که رویکردهای باززایشی هدفشان جایگزینی یا بازیابی بافت عصبی از دسترفته است. در این مطالعه، پژوهشگران از موشهایی استفاده کردند که ضایعات ناشی از سکته در آنها ایجاد شده بود و پس از پایدار شدن فاز حاد، سلولهای بنیادی عصبی انسانی را به نواحی مغزی آسیبدیده تزریق کردند. زمانبندی پیوند از نظر موفقیت استقرار سلولها بسیار حیاتی است: کارهای پیشین تیم نشان داده بود که مغز باید به پنجرهای از ثبات پس از سکته برسد تا پیوند بهطور مؤثر صورت گیرد.
برای پیگیری سلولهای کاشتشده، تیم تحقیقاتی از روشهایی مانند ایمنوهیستوشیمی (immunohistochemistry)، نشانگرهای مولکولی، و آزمونهای عملکردی رفتاری در یک پیگیری پنج هفتهای استفاده کرد. بخش عمدهای از سلولهای پیوندی در محل تزریق باقی ماندند، ویژگیهای مورفولوژیک و مولکولیِ سلولهای نورونی ناب را نشان دادند و رشتههایی (پروژکشنهایی) را گسترش دادند که با نورونهای بومی و مدارهای محلی تماس برقرار کردند. پژوهشگران همزمان بازآرایی عروقی را نیز ثبت نمودند—رگها علائم خودترمیمی را نشان دادند—و نشانگرهای التهابی کاهش یافتند و خواص سد خونی-مغزی بهبود پیدا کرد، که همهٔ این عوامل محیطی مساعدتری برای بازیابی فراهم میکنند.
یافتههای کلیدی و پیامدها برای بهبود سکته
یافتههای اصلی سه جنبه مهم را شامل میشوند: نخست، سلولهای بنیادی عصبی انسانی پیوندی قادرند در مغز بالغ آسیبدیده زنده بمانند و به سلولهایی شبیه نورون تمایز یابند؛ دوم، این سلولها میتوانند از نظر ساختاری یکپارچه شوند و تماسهای سیناپسی با بافت میزبان برقرار کنند؛ سوم، پیوند سلولی بهنظر میرسد فرایندهای باززایشی ثانویهای مانند آنژیوژنز (ترمیم رگهای خونی) و تعدیل دستگاه ایمنی را القا میکند. از منظر عملکردی، موشهای تحت درمان نسبت به گروه شاهد عملکرد حرکتی بهتری نشان دادند—که این نشانهٔ مهمی در ترجمه بالینی است، زیرا اختلالات حرکتی یکی از پیامدهای مهَلک سکته محسوب میشوند.
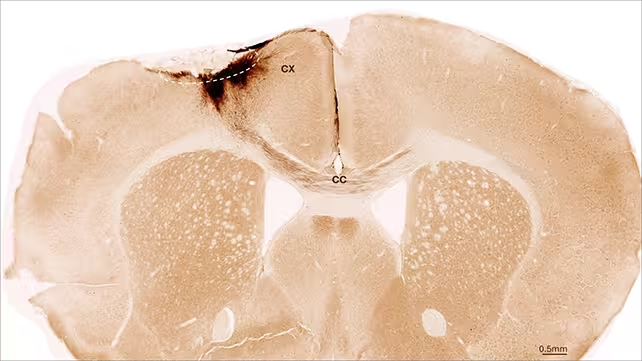
این نتایج مفهوم اینکه درمانهای مبتنی بر سلول میتوانند روزی عملکردهایی را که اکنون بازگشتناپذیر در نظر گرفته میشوند بازگردانند، تقویت میکند. همچنین اهمیت ترکیب اندازهگیریهای بقا، ارزیابی اتصالپذیری نورونی، سلامت عروقی، التهاب و رفتار را هنگام ارزیابی استراتژیهای باززایشی برای سیستم عصبی مرکزی نشان میدهد. به عبارت دیگر، ارزیابی موفقیت پیوند نباید فقط به بقا یا بیان نشانگرهای ابتدایی محدود شود، بلکه باید شواهدی از عملکرد سیناپسی، مشارکت در مدارهای عصبی و اثرات شبکهای مانند بهبود رگزایی و ثبات سد خونی-مغزی را نیز نشان دهد.
چالشها، ایمنی و مسیر ترجمه بالینی
علیرغم دادههای نویدبخش در مرحله پیشبالینی، موانع متعددی پیش از کاربرد انسانی باقی مانده است. ایمنی بلندمدت باید اثبات شود: سلولهای پیوندی نباید تکثیر خارج از کنترل یا مهاجرت به نواحی غیرمقصد داشته باشند. مسیر و روش تحویل بهینه (مانند تزریق موضعی، اینتراونتریکولار یا روشهای هدایتشده تصویربرداری)، دوز مؤثر و پنجرههای زمانی مناسب نیاز به پالایش دارند. سازگاری ایمنی (immune compatibility) و تبدیل نتایج از مغز کوچکتر و نسبتاً ساده موش به معماری بزرگتر و پیچیدهتر مغز انسان، چالشی بزرگ در ترجمه است. در نهایت، مسیرهای نظارتی برای محصولات سلولی نیازمند آزمونهای چندساله و سختگیرانه ایمنی و اثربخشی هستند.
تیم تحقیقاتی بر احتیاط و خوشبینی سنجیده تأکید میکند. به گفته محققان ارشد، تحلیلهای آنها فراتر از اثرات پس از پیوند فوری است و بررسی میکند که آیا سلولهای نوین واقعاً اتصالات عصبشناختی برقرار میکنند یا خیر—معیاری اساسی برای بازیابی معنادار عملکرد. این مطالعات علاوه بر اثبات بقا و تمایز، باید شواهدی از تأثیرات بلندمدت روی پلاستیسیتی شبکهای، پایداری سیناپسی و عدم بروز پدیدههای نامطلوب همچون تشکیل تومور یا گلیوز شدید ارائه کنند.
بینش کارشناسی
دکتر Maria Alvarez، یک متخصص فرضی در باززایی عصبی، چنین اظهار نظر میکند: 'این مطالعه اهمیت دارد زیرا نه تنها بقای سلولها را مستندسازی کرده بلکه یکپارچگی ساختاری و ترمیم بافتهای مجاور را نیز نشان میدهد. آن ترکیب—نوروزنز (تولید نورون) همراه با تعدیل عروقی و ایمنی—ممکن است برای بازیابی عملکرد پایدار ضروری باشد. با اینحال، برای ترجمه این نتایج لازم است که موضوعاتی مانند رد ایمنی، پایش بلندمدت و اطمینان از اینکه سلولهای پیوندی در مدارهای پیچیده انسانی رفتار مناسبی دارند، مورد توجه قرار گیرند.' این دیدگاه نشان میدهد که صِرف مشاهده تمایز نورونی و بقا کافی نیست؛ نیاز است سازگاری عملکردی و ایمنی در بلندمدت نیز اثبات شود.
نتیجهگیری
این مطالعه شواهد پیشبالینی محکمی ارائه میدهد که سلولهای بنیادی عصبی انسانی میتوانند استقرار یابند، تمایز پیدا کنند و فرایندهای ترمیمی را در مغز موشهای آسیبدیده ناشی از سکته القا کنند. یافتهها شامل یکپارچگی نورونی، ترمیم خودبهخودی عروق، کاهش التهاب و بهبود نتایج حرکتی هستند. هرچند که این نتایج برای توسعه درمانهای سکتهای در آینده امیدوارکنندهاند، ترجمه به انسان نیازمند مطالعات ایمنی طولانیمدت، بهینهسازی زمانبندی و روش تحویل، و آزمونهای بالینی دقیق است. این پژوهش فصل مهمی را به رشته نورولوژی باززایشی اضافه میکند و نشان میدهد که ترکیب مکانیزمهای سلولی و بافتی ممکن است روزی توانایی بازگرداندن عملکردهای از دسترفته بر اثر سکته را فراهم آورد.
برای ارائه دیدگاهی تخصصیتر و کاربردیتر از یافتهها، نکات فنی زیر را میتوان بهعنوان جهتهای ضروری در پژوهشهای آینده در نظر گرفت: بررسی نشانگرهای تمایز مانند NeuN (برای نورون بالغ)، DCX (برای نورونهای در حال تکامل)، سیناپتوفسین و PSD-95 (برای شناسایی تشکیل سیناپس)؛ سنجش بازآرایی عروقی با نشانگرهای اندوتلیال مانند CD31 و عوامل ماتریکسی مانند لامینین؛ ارزیابی واکنش ایمنی موضعی با نشانگرهایی مانند Iba1 برای میکروگلیا و GFAP برای آستروسیتها؛ و بررسی پروتئینهای اتصالدهندهٔ سد خونی-مغزی مانند کلودین-5 و اوکلودین. این نوع دادهها میتواند استدلالی قویتر برای مکانیسمهای بنیادی پشت ترمیم فراهم کند و برای آمادهسازی مطالعات بالینی حیاتی است.
در بعد کلانتر، تحلیلهای هزینه-فایده، دسترسی تولیدی (مانند تولید سلولهای اولیه انسانی در مقیاس GMP)، و چارچوبهای نظارتی بینالمللی باید به موازات پیشرفت علمی مورد توجه قرار گیرند تا مسیر ترجمه بالینی تسهیل شود. همچنین، تلفیق درمانهای سلولی با روشهای توانبخشی عصبی هدفمند، تحریک مغناطیسی یا الکتریکی و داروهای تسهیلکننده پلاستیسیتی میتواند یک استراتژی چندوجهی موثر برای بهبود نتایج بیماران سکتهای فراهم آورد.
در کل، این کار نشان میدهد که رویکردهای سلولی میتوانند فراتر از ترمیم یک سلول بهتنهایی عمل کنند و شبکهای از فرایندهای دفاعی و باززایشی را فعال سازند—پدیدهای که میتواند مبنای نسل بعدی درمانهای سکته و بازتوانی عصبی قرار گیرد. با ادامه پژوهشهای دقیق، شواهد بالینی و چارچوبهای قانونی مناسب، امید است که در آیندهای نهچندان دور درمانهایی مبتنی بر سلول برای بازگرداندن تواناییهای از دسترفته ناشی از سکته در بیماران انسانی به واقعیت بپیوندد.
منبع: sciencealert

ارسال نظر