9 دقیقه
پژوهشگران دانشگاه ماساچوست امهرست از توسعه یک واکسن نانوذراتی خبر دادهاند که در مطالعه روی موشها از رشد چند نوع تومور جلوگیری کرده و تا پایان دورهٔ آزمایشی ۲۵۰ روزه، اثربخشی محافظتی قابلتوجهی نشان داده است. این فرمول آزمایشی آنتیژنهای مرتبط با سرطان را با یک آدجوانت قدرتمند و ترکیبی (آنچه نویسندگان «سوپر آدجوانت» نامیدهاند) همراه میکند تا سیستم ایمنی را آموزش دهد سلولهای سرطانی را شناسایی و قبل از تثبیت شدن، نابود کند. یافتهها نشاندهندهٔ رویکردی امکانپذیر برای واکسیناسیون پیشگیرانه و ایمنیدرمانی سرطان با استفاده از فناوری نانو و استراتژیهای چندآدجوانتی هستند.
چگونه واکسن، سیستم ایمنی را آموزش میدهد
واکسنی که در این مطالعه بهکار رفته از نانوذرات لیپیدی بهعنوان حامل استفاده میکند تا بخشهای قابلشناسایی از سلولهای سرطانی را بهصورت آنتیژن در معرض دستگاه ایمنی قرار دهد؛ آنتیژن در واقع برچسب مولکولی است که به سلولهای ارائهدهندهٔ آنتیژن و لنفوسیتها هشدار میدهد یک تهدید وجود دارد. در کنار این آنتیژنها، محتوای نانوذرات شامل آنچه پژوهشگران «سوپر آدجوانت» مینامند، یعنی دو محرک ایمنی همزمان است که بهصورت هممحصور درون نانوذرات منتقل میشوند تا گستره و شدت پاسخ ایمنی را افزایش دهند.
بهطور فنی، این ترکیب مانند یک برنامهٔ آموزشی برای دستگاه ایمنی عمل میکند: سلولهای ارائهدهندهٔ آنتیژن (APCها) — بهویژه دندریتیکها — نانوذرات را گرفته، آنتیژنها را پردازش و قطعات آن را روی مولکولهای MHC کلاس I و II ارائه میکنند. این فرایند امکان فعالسازی لنفوسیتهای T CD8+ کشنده و CD4+ کمککننده را فراهم میسازد که برای نابودی سلولهای بدخیم ضروریاند. همزمان، آدجوانتهای ترکیبی موجب تقویت تولید سایتوکاینها، افزایش مهاجرت سلولهای ایمنی به گرههای لنفاوی و ایجاد محیطی میشوند که پاسخ ایمنی را تقویت و تثبیت میکند.
این استراتژی هم پاسخ سلولی (سلولهای T) و هم پاسخ هومورال (پاسخ پادتن توسط سلولهای B) را تحریک میکند، اما نکتهٔ کلیدی در تحقیقات اخیر، توانایی نانوذرات در القای یک حافظهٔ ایمنی طولانیمدت است که میتواند در برابر درگیریهای بعدی با سلولهای سرطانی مقاومت کند. ترکیب آنتیژنهای وسیع و آدجوانتهای قوی، بهویژه وقتی بهصورت همزمان به همان سلول ارائهدهندهٔ آنتیژن منتقل شوند، احتمال ایجاد یک پاسخ پلیکلونال و «گسترده» را افزایش میدهد که میتواند از ظهور فرار ایمنی ناشی از تغییرات جهشی جلوگیری کند و به محافظت متقاطع علیه انواع مختلف تومور کمک کند.
چرا نانوذرات؟
نانوذرات ابزارهای تحویلِ بسیار ریز و مهندسیشدهای هستند که چند مزیت عملی و بیولوژیکی مهم دارند: آنها مولکولهای حساس را محافظت میکنند، انتشار و آزادسازی محتوا را کنترل میکنند، و میتوانند با طراحی اندازه، بار سطحی و ترکیب لیپیدی، هدفگیری به گرههای لنفاوی یا سلولهای ارائهدهندهٔ آنتیژن را بهبود دهند. نکتهٔ عملی دیگر این است که با بستهبندی همزمان آنتیژن و آدجوانت در یک ذرهٔ واحد، احتمال آنکه یک APC هر دو محرک را همزمان دریافت کند افزایش مییابد؛ این همدریافتِ همزمان موجب فعالسازی چندمسیرهای ایمنی میشود که هماهنگتر و بادوامتر از واکنشهای ناشی از اجزاِ جداگانه است.
در سطح مولکولی، نانوذرات لیپیدی میتوانند جذب سلولهای فاریندریتی یا ماکروفاژها را تسهیل کنند و امکان «عرضهٔ متقاطع» (cross-presentation) آنتیژنها روی MHC کلاس I را برای فعالسازی سلولهای CD8+ فراهم سازند؛ این امر برای ایجاد پاسخ کشنده علیه سلولهای سرطانی ضروری است. همچنین طراحی نانوذرات میتواند نرخ آزادسازی آنتیژن و آدجوانت را تنظیم کند تا فازهای اولیه و ثانویهٔ پاسخ ایمنی را حمایت کند، و با اصلاح پوشش سطحی میتوان توزیع زیستی و نیمهعمر ذرات را بهینه کرد.
از منظر تولید و توسعهٔ بالینی، نانوذرات لیپیدی مزایایی در فرایندهای تولید، ثبات محصول و امکان فرمولاسیون مجدد برای انواع مختلف آنتیژن ارائه میدهند که آنها را برای تولید واکسنهای شخصیسازیشده یا واکسنهای با طیف وسیع مناسب میسازد. با این حال، چالشهایی مانند کنترل کیفیت، تطابق با استانداردهای GMP، و ارزیابی ایمنی بلندمدت نیز باید بهدقت بررسی شوند.
نتایج: بقا، محافظت متقاطع و پایداری
در مجموعهٔ نخست آزمایشها، پژوهشگران نانوذرات را با پپتیدهای اختصاصی ملانوم بارگذاری کردند و موشها را پیش از قرار گرفتن در معرض سلولهای ملانوم واکسینه نمودند. نتایج چشمگیر بود: ۸۰ درصد موشهای واکسینهشده در طول دورهٔ ۲۵۰ روزه زنده ماندند و بدون تومور باقی ماندند، درحالیکه گروههای کنترل فاقد واکسن و گروههایی که فرمولاسیونهای جایگزین دریافت کرده بودند، تماماً در عرض هفت هفته تومور گرفتند و مرگ مشاهده شد. این تفاوت نشاندهندهٔ یک اثر حفاظتی قوی و طولانیمدت در مدل ملانوم است.
برای آزمون دامنهٔ محافظت، تیم تحقیقاتی به سراغ یک آنتیژن عمومیتر بهنام لیزات تومور رفت؛ لیزات تومور از سلولهای سرطانی شکستهشده تهیه میشود و مخلوطی از پروتئینها و آنتیژنهای مختلف تومور را در خود دارد. موشهایی که با فرمولاسیون لیزات واکسینه شدند، در معرض سه نوع سرطان مختلف قرار گرفتند: ملانوم، سرطان پانکراس و سرطان پستان سهگانه منفی (triple-negative). میزان محافظت بسته به نوع تومور متفاوت بود اما در مجموع قابلتوجه بود: برای مدل پانکراس ۸۸ درصد بدون تومور ماندند، برای سرطان پستان سهگانه منفی ۷۵ درصد محافظت بهدست آمد و برای ملانوم ۶۹ درصد موشها تومور نگرفتند.
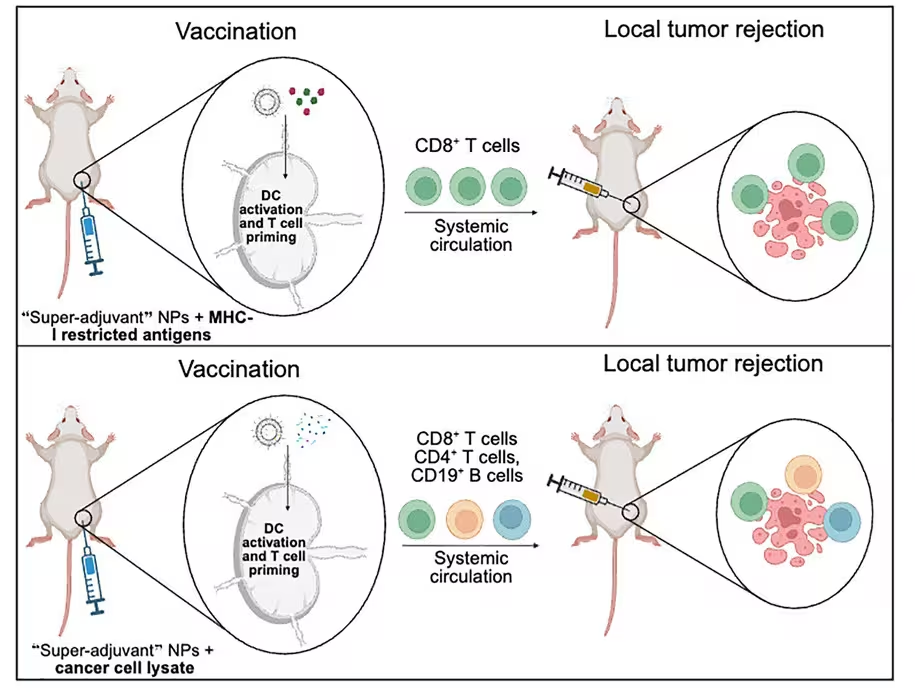
چکیدهٔ تصویری از چگونگی عملکرد واکسن سرطان. (Kane et al., Cell Rep. Med. 2025)
در آزمایشهای پیگیری برای شبیهسازی انتشار تومور (متاستاز)، تیم مشاهده کرد تمام حیوانات زندهمانده همچنان عاری از تومور باقی ماندند که این یافته نشاندهندهٔ ایجاد یک حافظهٔ ایمنی پایدار است. حافظهٔ ایمنی بهمعنای حضور لنفوسیتهای T حافظهای و احتمالاً سلولهای B حافظهای است که میتوانند در مواجههٔ مجدد با آنتیژنهای تومور سریعاً فعال شوند و پاسخ حفاظتی ایجاد کنند. همانطور که پِرابانی آتوکوراله، مهندس زیستپزشکی در UMass Amherst، بیان میکند: «با مهندسی این نانوذرات برای فعالسازی دستگاه ایمنی از طریق فعالسازی چندمسیرهای که با آنتیژنهای مرتبط با سرطان ترکیب میشود، میتوانیم رشد تومور را با نرخهای بقا چشمگیر پیشگیری کنیم.»
این نتایج علاوهبر نشان دادن اثربخشیِ بالقوهٔ واکسن، اطلاعات مهمی دربارهٔ مکانیسمهای محافظتی فراهم میآورند؛ بهعنوان مثال ایجاد پاسخ پلیکلونال که چندین اپیتوپ را هدف میگیرد، امکان فرار ایمنی را کاهش میدهد و میتواند منجر به انتقال اپیتوپها (epitope spreading) شود که طی آن پاسخ ایمنی اولیه به اپیتوپهای دیگر گسترش مییابد و دامنهٔ محافظت افزایش پیدا میکند. همچنین، دادههای طولانیمدت ۲۵۰ روزه در موشها نشاندهندهٔ ثبات پاسخ و فقدان افت سریع ایمنی است که در برخی واکسنها مشاهده میشود.
پیامدها، محدودیتها و گامهای بعدی
نتایج منتشرشده در Cell Reports Medicine نشان میدهد این پلتفرم انعطافپذیر میتواند برای هدفگیری انواع مختلف سرطان تطبیق یابد یا بهصورت پیشگیرانه در بیماران پرخطر استفاده شود. استفاده از لیزات تومور بهعنوان آنتیژن نشاندهندهٔ یک رویکرد نزدیک به «همهگیر» است که در آن یک واکسن میتواند ایمنی را علیه مجموعهای از آنتیژنهای تومور و نه تنها یک جهش یا پپتید خاص، تحریک کند. این امر نقش مهمی در توسعه واکسنهای پیشگیرانه سرطان دارد، بهویژه در جمعیتهایی که ریسک بالای ابتلا دارند یا بهعنوان یک لایهٔ حفاظتی همراه با غربالگریهای بالینی کاربرد خواهد داشت.
با این حال، نویسندگان به یک هشدار مهم اشاره میکنند: این آزمایشها در مدل موش انجام شدهاند. هرچند مدلهای حیوانی برای ارزیابیهای اولیه و درک مکانیک عمل ضروریاند، اما نتایج آنها تضمینی برای ایمنی و کارآیی در انسانها نیست. قبل از هر کاربرد بالینی، واکسن نیازمند پروفایلینگ ایمنی پیشبالینی گسترده، بهینهسازی دوز و نسبت آدجوانت، و آزمایشهای دقیق سمیت خواهد بود. طراحی آزمایشهای انسانی نیز باید با معیارهای ایمنی، شناسایی شاخصهای بیومارکر ایمنی و تعیین مؤلفههای پاسخ حفاظتی همراه باشد.
مهمترین چالشهای ترجمهٔ این فناوری به کلینیک شامل موارد زیر است: تولید با کیفیت و قابل تکرار نانوذرات در مقیاس GMP، تضمین ثبات فرمولاسیون و انطباق با مقررات، تعریف دقیق آنتیژن هدف یا انتخاب استراتژی لیزات مناسب برای هر نوع سرطان، و پیشبینی یا شناسایی عوارض احتمالی ایمنی مانند واکنشهای التهابی سیستمیک یا سندرم آزادسازی سایتوکاین. همچنین انتخاب گروههای هدف برای کارآزماییهای فاز اول بالینی — بهعنوان مثال بیماران با ریسک بالا یا افراد تحت درمانهای استاندارد — نیازمند تامل دقیق و طرحهای اخلاقی و علمی است.
- زمینهٔ علمی: تحویل با نانوذرات و استراتژیهای چندآدجوانتی جزو روندهای رو به رشد در ایمنیدرمانی و توسعه واکسنهای ضدسرطان هستند.
- کشف کلیدی: پیشگیری قوی و پایدار از تومور در چند مدل موشی بهمدت ۲۵۰ روز که نشاندهندهٔ ایجاد حافظهٔ ایمنی قابلتوجه است.
- گامهای بعدی: تستهای ایمنی، تنظیم فرمولاسیون و در نهایت آزمایشهای انسانی مشروط بر حمایت نتایج پیشبالینی و تایید ایمنی.
این پژوهش بخشی از تلاشهای گستردهتری است که هدفشان ساخت واکسنهایی است که نهتنها سرطان را درمان کنند، بلکه از آغاز بهصورت پیشگیرانه جلوی شکلگیری آن را بگیرند. اگر مسیر ترجمهٔ بالینی موفقیتآمیز باشد، این رویکرد میتواند نقشهٔ راهی برای استراتژیهای ایمنیپیشگیرانه در انکولوژی فراهم کند — از واکسنهای مبتنی بر لیزات یا نئوآنتیژنهای اختصاصی تا رویکردهای ترکیبی با مهارکنندههای نقطهٔ کنترل ایمنی و درمانهای اختصاصی دیگر. در کنار فرصتهای بالینی، این کار چراغ راهی برای مطالعات بنیادی روی حافظهٔ ایمنی توموری، تعیین نشانگرهای پاسخ و بهینهسازی طراحی نانوذرات بهمنظور افزایش کارآیی و ایمنی فراهم میآورد.
منبع: sciencealert

ارسال نظر