9 دقیقه
پژوهشگران مؤسسه علوم اعصاب (IN)، مرکزی مشترک از شورای تحقیقات ملی اسپانیا (CSIC) و دانشگاه میگل هرناندز الچه (UMH)، گزارش میدهند که بدن برای شناسایی سرما از دو سیستم مولکولی متمایز استفاده میکند. پوست عمدتاً بر کانال یونی TRPM8 اتکا دارد، در حالی که اندامهای داخلی مانند ریهها و معده بیشتر وابسته به TRPA1 هستند. این تفکیک تا حد زیادی توضیح میدهد که چرا یک نسیم سرد، عبور هوای یخزده از راههای هوایی و نوشیدنی یخزده احساسات بسیار متفاوتی ایجاد میکنند.
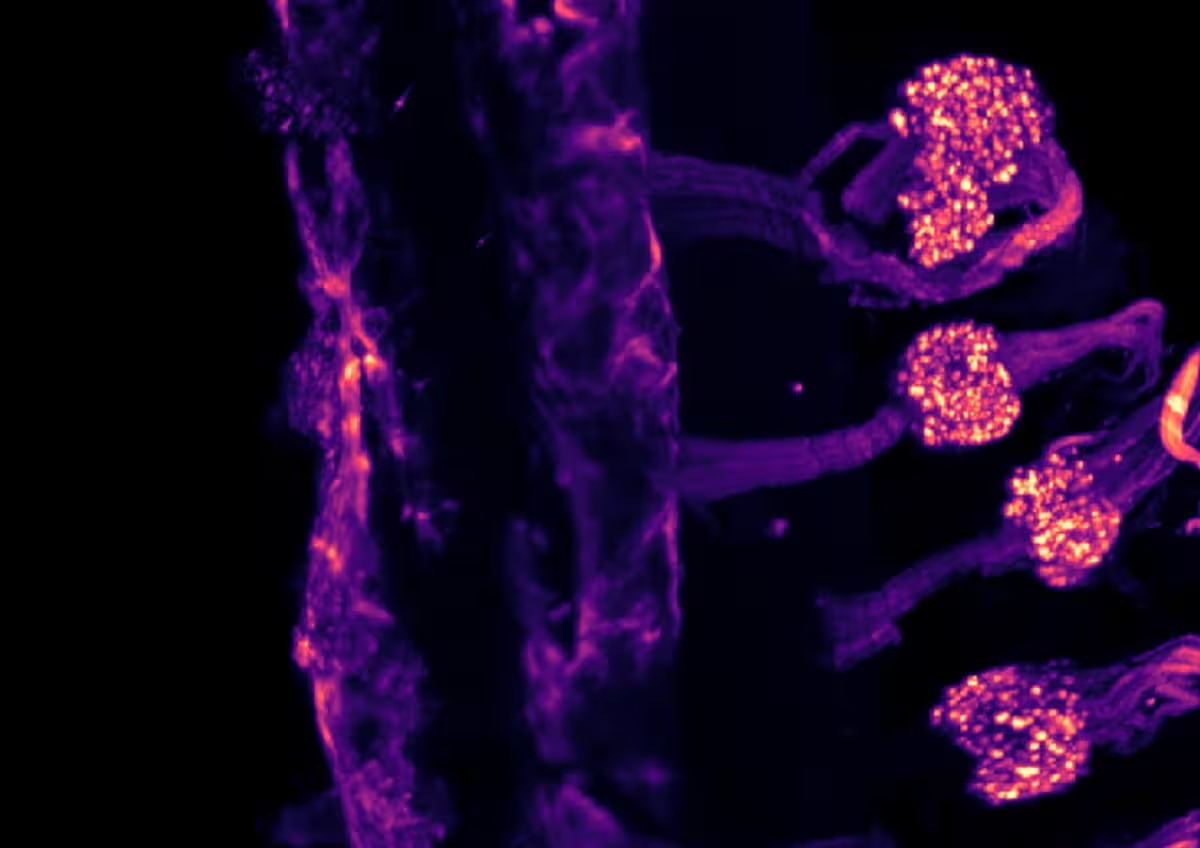
تصویر میکروسکوپی لایتشیت که بیان کانال یونی TRPM8 را در گانگلیونهای حسی یک موش در دوران جنینی نشان میدهد؛ پس از شفافسازی با تکنیک iDISCO.
دو حسگر، دو تجربه متفاوت از سرما
زیستشناسی حسی تا کنون اغلب شناسایی سرما را بهصورت یک مسیر واحد در نظر میگرفت، اما مطالعه جدید این سادهسازی را بههم میزند. در پوست، TRPM8 بهعنوان مبدل اصلی برای سرماهای محیطی عمل میکند؛ این کانال بهدقت برای شناسایی افتهای نسبتاً کوچک دما تنظیم شده و میتواند رفتارهای حفاظتی مانند جستجوی گرما، خشکاندن یا لرزیدن را فعال کند. در مقابل، پژوهشگران نشان دادند که در بافتهای احشایی، TRPA1 نقش پیشرو را در ثبت سرما ایفا میکند. به همین دلیل است که سیگنالهای عصبی تولیدشده توسط نوک انگشتی که سرد شده است در مسیرها و بهصورت کدگذاریشدهای متفاوت از سیگنالهایی هستند که وقتی هوای یخ به ریهها میرسد یا نوشیدنی سرد به گلو برخورد میکند، ایجاد میشوند.
این تفکیک میان گیرندههای حرارتی توضیح میدهد که چگونه بازشناسی دما با هدفهای عملکردی متفاوت تنظیم شده است؛ یکی برای واکنش سریع و رفتاری در برابر تغییرات محیطی و دیگری برای تنظیم پیچیدهتر فرآیندهای درونی مثل تنفس، گوارش و هموستاز داخلی. این دیدگاه با دادههای مولکولی و فیزیولوژیک که در ادامه گزارش شده است، همراستا میباشد.

اوا کوینترو، پابلو هرناندز-اورتگو، آنا گومز دل کامپو، فلیکس ویانا و کاتارینا گرز-بارلاگ، پژوهشگران IN CSIC-UMH.
روشهایی که تیم برای اثبات مسیرهای مجزای سرما بهکار برد
محققان ترکیبی از تصویربرداری کلسیم در سلولهای زنده و ثبتهای الکتروفیزیولوژیک را بهکار گرفتند تا عملکرد نرونهای حسی را هنگام مواجهه با سرما مشاهده کنند. آنها نرونهای گانگلیون تریژمینال، که حسهای صورت و سطح پوست سر را منتقل میکند، را با نرونهای گانگلیون واگال، که ورودی از اندامهای داخلی را هدایت میکنند، مقایسه کردند. مسدودکنندههای دارویی که بهطور انتخابی TRPM8 یا TRPA1 را مهار میکردند، به شناسایی اینکه کدام کانالها پاسخها را در هر جمعیت نورونی هدایت میکنند کمک نمود.
علاوه بر این، آزمایشهای ژنتیکی این استنتاج را تقویت کردند. موشهایی که بهصورت مهندسیشده فاقد TRPM8 بودند، پاسخهای سرما در نرونهای مرتبط با پوست را از دست دادند، در حالی که موشهایی که TRPA1 نداشتند حساسیت به سرما در نرونهای متصل به اندامهای داخلی را کاهش دادهاند. تحلیل بیان ژنها نشان داد که این دو کانال یونی بهطور متفاوت در گانگلیونهای حسی بیان میشوند و حضور مولکولی آنها با عملکرد فیزیولوژیک تطابق دارد.
در لایههای تجربی، تیم از محرکهای دمایی کنترلشده و پروتکلهای تکرارشونده استفاده کرد تا پاسخدهی نرونها را در بازههای مختلف دمایی، شدت و مدت قرارگیری در سرما بررسی کند. چنین طراحی تجربی اجازه داد به تفکیک آستانههای فعالسازی TRPM8 و TRPA1 و همچنین بررسی پدیدههایی مانند سازگاری (adaptation) و سوگیری پاسخها به سرما بپردازند که برای طراحی داروهای هدفمند اهمیت دارد.
چرا بافتهای مختلف به حسگرهای متفاوت برای سرما نیاز دارند
شکل و عملکرد تابع یکدیگرند. نقش پوست احساس شرایط خارجی و تحریک پاسخهای رفتاری سریع برای حفاظت از کل ارگانیسم است. TRPM8 برای این نقش بهینه شده و به سرماهای مرتبط با محیط پاسخ میدهد، تا رفتارهای فرار یا محافظتی را فعال کند. برعکس، اندامهای داخلی نیازمند سازوکارهای مدیریتی متفاوتی هستند: آشکارسازی سرما در راههای هوایی یا روده میتواند بر الگوهای تنفسی، هضم و رفلکسهایی اثر بگذارد که بیشتر مربوط به هموستاز داخلی و تنظیم عملکردهای فیزیولوژیک درونیاند تا فرار فوری از تهدید محیطی.
این تقسیم کار مولکولی توضیح میدهد که چگونه سامانه عصبی مرکزی میتواند اطلاعات دمایی را از منابع مختلف بهگونهای تفکیکشده دریافت و پردازش کند، بهطوری که پاسخ نهایی متناسب با بافت هدف و نیاز زیستسازمانی باشد. برای مثال، تحریک TRPM8 در پوست ممکن است رفتار جویابانه یا تولید گرما از طریق ترمورگولاسیون را آغاز کند، در حالی که فعال شدن TRPA1 در مخاط راههای هوایی میتواند منجر به تغییر در ریتم تنفس یا افزایش ترشحات حفاظتی شود.
فلیکس ویانا، هممدیر آزمایشگاه انتقال حسی و درد در IN، میگوید: «پوست با حسگرهای ویژهای مجهز شده است که به ما امکان میدهد سرما را در محیط تشخیص داده و رفتارهای دفاعی متناسب را اجرا کنیم.» او اضافه میکند: «در مقابل، شناسایی سرما در داخل بدن ظاهراً به مدارها و گیرندههای مولکولی متفاوتی وابسته است که بازتابدهنده نقش عمیقتر فیزیولوژیک آن در تنظیم داخلی و پاسخ به محرکهای محیطی است.»
پیامدها برای پزشکی و علم پایه
درک اینکه TRPM8 و TRPA1 نقشهای بافتی مشخصی دارند، مسیرهای جدیدی را برای درمان اختلالات حساسیت به سرما باز میکند. نوروپاتیها و سایر شرایط میتوانند درک غیرطبیعی از سرما را ایجاد کنند که بهصورت آلودینیا (درد ناشی از محرک غیر دردناک) یا کاهش توانایی در شناسایی دماهای بسیار پایین نمود پیدا میکند. درمانهای هدفمند که کانال یونی غالب در یک بافت خاص را تنظیم میکنند میتوانند عوارض جانبی را کاهش و اثربخشی را افزایش دهند.
در سطح بالینی، این یافتهها به توسعه آزمونهای تشخیصی حساسیت به سرما کمک خواهند کرد که میتوانند تفاوت میان نقائص محورهای TRPM8-محور و TRPA1-محور را تفکیک کنند. چنین تمایزی برای انتخاب استراتژیهای درمانی—از داروهای کوچک مولکول تا درمانهای ژنی یا ایمونومدولاسیون—حایز اهمیت است. علاوه بر این، درک دقیقتر توزیع و عملکرد این کانالها میتواند در طراحی داروهایی با هدف کاهش درد سرمازدگی (cold allodynia) یا بازگرداندن حس دمایی در بیماران با نوروپاتی مفید باشد.
کاتارینا گرز-بارلاگ، نویسنده اول مقاله، اظهار داشت: «یافتههای ما دیدی پیچیدهتر و دقیقتر از اینکه چگونه سامانههای حسی در بافتهای مختلف اطلاعات حرارتی را کدگذاری میکنند، ارائه میدهد. این موضوع راههای جدیدی برای مطالعه ادغام این سیگنالها و چگونگی تغییر آنها در شرایط پاتولوژیک، مانند برخی نوروپاتیها که حساسیت به سرما را مختل میکنند، باز میکند.»
این پژوهش بخشی از تلاشی بینالمللی گسترده است که توسط برنامه علوم مرز انسانی (Human Frontier Science Program) تأمین مالی میشود و از سوی برنامه ملی تحقیقات علمی و فنی و نوآوری اسپانیا، برنامه سوئرو اوچوا برای مراکز برجسته و دولت منطقهای والنسیا حمایت میشود. این همکاریها هدف دارند پایههای مولکولی درک سرما را در گونههایی که در محیطهای شدید زیستی زندگی میکنند ردیابی کنند و ارتباطی میان علوم اعصاب مولکولی، اکولوژی و تکامل برقرار سازند.
دیدگاه کارشناسی
دکتر ماریا تورس، دانشمند علوم اعصاب حسی که در این مطالعه مشارکت نداشته است، توضیح میدهد که چرا این یافته فراتر از زیستشناسی پایه اهمیت دارد: «این پژوهش روشن میکند که چرا تجربه سرما بسیار متغیر است. در مطب بالینی اغلب بیمارانی را میبینیم که حساسیت به سرما محدود به یک ناحیه از بدن است. اگر در نظر بگیریم که اعصاب و کانالهای مختلف برای بافتهای مختلف سرما را رمزگذاری میکنند، طراحی آزمونهای تشخیصی و درمانهای هدفمند سادهتر میشود. تمایز میان TRPM8 و TRPA1 یک قطعه مهم از این پازل است.»
علاوه بر جنبههای بالینی، این نتایج برای تحقیقاتی که به دنبال فهم سازگاری فیزیولوژیک با محیطهای سرد هستند نیز مهم است. مطالعه الگوهای بیان و تطابق کانالهای دما میتواند به توضیح چگونگی تطور پاسخهای حرارتی در گونههای مختلف و همچنین استراتژیهای حفاظتی پایهای در برابر سرمای محیطی کمک کند.
نتیجهگیری
کشف اینکه پوست و اندامهای داخلی از حسگرهای مولکولی متمایزی برای سرما استفاده میکنند، درک ما از ادراک حرارتی را بازسازی میکند و مسیرهای عملی برای درمان اختلالات حسی ارائه میدهد. با نقشهبرداری از نحوه توزیع و عملکرد TRPM8 و TRPA1 در گانگلیونهای حسی، پژوهشگران تصویری روشنتر از چگونگی ثبت و پاسخ دستگاه عصبی به دما فراهم ساختهاند. مطالعات آینده بررسی خواهند کرد که این مسیرها چگونه در حین احساسات پیچیده با هم تعامل میکنند — بهعنوان مثال وقتی فردی همزمان هوای سرد را تنفس میکند و هم سطح سردی را لمس میکند — و آیا تنظیم انتخابی این کانالها میتواند حساسیت پاتولوژیک به سرما را کاهش دهد یا خیر.
افقهای بعدی تحقیق شامل بررسی مکانیزمهای مولکولی در سطح زیرسلولی برای تفاوت آستانهها و زمانبندی پاسخها، مطالعه نقش نوروایمنولوژی در تغییرات حساسیت به سرما در بیماریهای التهابی و توسعه مدلهای حیوانی و بافتی پیشرفته برای آزمون درمانهای اختصاصی خواهد بود. چنین مطالعاتی میتوانند به پیوند علوم پایه با کاربردهای بالینی و طراحی داروهایی با هدفگیری دقیق در حوزه گیرندههای حرارتی منجر شوند.
منبع: scitechdaily
نظرات
نووا_x
خلاصه: پوست TRPM8، اندامها TRPA1. ساده ولی عمیق. منتظرم ببینم این علم چطور میتونه درد سرما رو درمان کنه
آسمانگرد
تفکیک حسگرها منطقیه؛ یکی برای واکنش فوری، یکی برای تنظیمات داخلی. اما تعاملشون وقتی همزمان فعالن چی میشه؟
کوینکس
خب خیلی جذابه ولی بنظر میاد خیلی سریع دارن نتیجه میگیرن از پایهای به بالینی، صبر لازمه
مهران
تو درمانگاه دیدم بیمار فقط تو انگشتاش درد سرما داشت، حالا منطقیه که گیرندهها فرق کنن، توضیح دادم براش سریع و ساده
لابکور
این جداسازی TRPM8 و TRPA1 قویست اما آیا تو انسان هم دقیقاً به همین شکل دیده میشه؟ آزمایشهای بالینی کجاست؟
دیتاپالس
وای یعنی وقتی نفس یخ میاد تو ریه فرق مولکولی داره؟ جالب و کمی ترسناک… فکرنمیکردم اینقدر متفاوت باشه


ارسال نظر