9 دقیقه
محققان نشان دادهاند که بازگرداندن تعادل فعالیت در گروهی بسیار کوچک از نورونها در آمگدالا میتواند اضطراب و کنارهگیری اجتماعی را در موشها محو کند. این نتیجه نشاندهنده مکانیزم عصبشناختی بسیار دقیقی است که میتواند راهنمای طراحی درمانهای مدارمحور در اختلالات عاطفی باشد. این یافته ارتباط مستقیمی با مفاهیمی مانند تعادل برانگیختگی-بازداری، گیرندههای کاینات و هدفگیری سلولمحور درمانها دارد.
تیم پژوهشی دریافت که بازتوازن فعالیت در یک مدار کوچک از آمگدالا به تنهایی کافی است تا اضطراب و کنارهگیری اجتماعی در موشها معکوس شود. این کشف به یک مکانیزم بسیار دقیق مغزی اشاره میکند که میتواند الهامبخش درمانهای روانپزشکی هدفمندتر و مبتنی بر مدارهای عصبی باشد. برای درک بهتر مسیر ترجمه این نتایج به درمانهای انسانی لازم است نوع سلولها، سیناپسها و شبکههای مرتبط بهدقت نقشهبرداری شوند.
چگونه یک مدار واحد تراز احساسات را به نفع اضطراب تغییر داد
این مطالعه به سرپرستی آزمایشگاه فیزیولوژی سیناپسی به رهبری Juan Lerma در مؤسسه علوم عصبی (IN) — یک همکاری بین Consejo Superior de Investigaciones Científicas (CSIC) و دانشگاه Miguel Hernández (UMH) الچه — نشان میدهد که نقصهای اضطرابی و اختلالات اجتماعی را میتوان به یک جمعیت مجزا از نورونها در آمگدالای کنارهبازال (basolateral amygdala) نسبت داد. با برگرداندن برانگیختگی نورونها به محدوده طبیعی در همان مدار، تیم توانست علائم رفتاری در موشها را معکوس کند؛ علائمی که در بسیاری وجوه شبیه به بخشهایی از اضطراب، افسردگی و انزوای اجتماعی در انسان بودند.
لرما میگوید: ما پیشتر میدانستیم که آمگدالا نقش مرکزی در ترس و اضطراب دارد، اما این کار نشان میدهد که فعالیت نامتعادل یک جمعیت سلولی مشخص بهتنهایی میتواند رفتارهای پاتولوژیک ایجاد کند. نتایج در مجله iScience منتشر شد و پنجرهای به سوی این باز میکند که چگونه جابجاییهای کوچک در سیگنالدهی عصبی میتواند وضعیتهای احساسی را بازشکل دهد. این پرسشهای تازه دربارهٔ علتشناسی اختلالات عاطفی و نقش مدارهای مخصوص را مطرح میکند.
مهندسی ژنتیکی برای ایجاد و سپس اصلاح عدم تعادل
برای آشکارسازی مکانیزم، پژوهشگران از یک خط موش ترانسژنیک استفاده کردند که ژن Grik4 را بیشابراز (overexpresses) میکند. این تغییر باعث افزایش گیرندههای کاینات نوع GluK4 روی نورونهای معینی میشود که در نتیجه آنها بیشبرانگیخته (hyperexcitable) میگردند. موشهای دارای ابراز بیش از حد Grik4 الگوهای آشکاری از اضطراب و کاهش تعامل اجتماعی نشان میدادند — فنوتیپهایی که این تیم برای نخستینبار در سال 2015 مشخص کرده بودند و به عنوان مدل رفتاری برای اختلالات عاطفی استفاده میشوند.
با بهکارگیری وکتورهای ویروسی و ابزارهای مولکولی، گروه سپس بهصورت انتخابی بیان Grik4 را در نورونهای آمگدالای کنارهبازال اصلاح کرد. این مداخله موضعی، ارتباط طبیعی با یک گروه پسسیناپسی از سلولهای مهاری در آمگدالای مرکزی-جانبی (centrolateral amygdala) — که به عنوان نورونهای با آتشگیری منظم شناخته میشوند — را بازساخت و نسبت برانگیختگی-مهاری (excitatory–inhibitory balance) را در سراسر میکرَدیوسِ مدار بازیابی نمود. از دیدگاه زیستشناسی سیناپسی، بازیابی این نسبت میتواند توانایی شبکه در پردازش تهدیدات و محرکهای اجتماعی را بازگرداند.
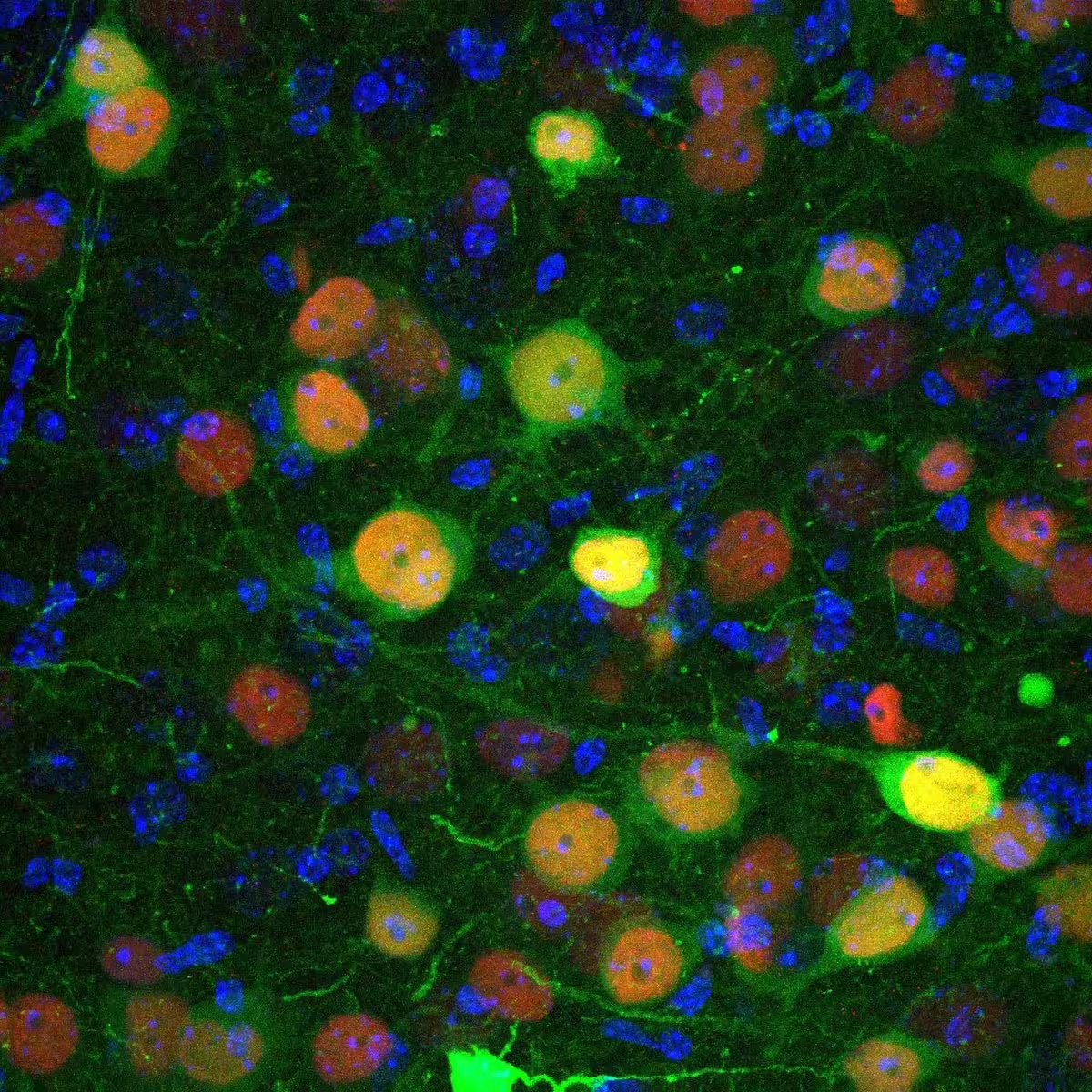
تصویر میکروسکوپ کنفوکال که سلولهای آمگدالای کنارهبازال را نشان میدهد که با ویروسی مهندسیشده برای وارد کردن پروتئین CRE ریکامبیناز (به رنگ قرمز) و پروتئین فلورسنت GFP (به رنگ سبز) آلوده شدهاند و بدینترتیب امکان مشاهده عفونت فراهم شده است.
اندازهگیری مدارها و رفتار بهصورت همزمان
تیم پژوهشی رکوردینگهای الکتروفیزیولوژیک را با مجموعهای از آزمونهای رفتاری تلفیق کرد تا تغییرات سیناپسی را به رفتار موش پیوند بزند. ثبتهای عصبی تأیید کرد که اصلاح بیان Grik4 نرخهای آتشگیری و پاسخهای سیناپسی در مسیر آمگدالای کنارهبازال به مرکزی-جانبی را نرمال میکند. از منظر رفتاری، موشهای درمانشده فضای باز را راحتتر کاوش کردند و علاقهٔ بازسازیشدهای به همنوعان ناشناس نشان دادند — معیارهای استاندارد برای کاهش اضطراب و بهبود انگیزه اجتماعی در جانوران آزمایشی.
نویسندهٔ اول، Álvaro García، ظرافت نتیجه را اینگونه توضیح داد: آن تنظیم متمرکز در یک میکرِدیوس آمگدالا کافی بود تا رفتارهای شبیهسازیشدهٔ اضطراب و کسریهای اجتماعی را معکوس کند — یک نجات بسیار مشخص. هدفگیری ژنتیکی و تعمیر موضعی با وکتورهای ویروسی به گروه اجازه داد تا علیت را در سطح مدار آزمون کند، بهجای اینکه به دارودرمانیهای گسترده متکی باشد. این رویکرد نشان میدهد که چگونه دستکاری در سطوح مولکولی و سلولی میتواند مستقیماً روی عملکرد شبکه و در ادامه رفتار تأثیر بگذارد.
نه همهجانبه، اما الگویی امیدوارکننده
نکتهٔ مهم این است که پژوهشگران همان روش را روی موشهای وحشی (wild-type) که بهطور طبیعی اضطراب بالاتری بروز میدادند نیز آزمودند. این مداخله در این جانوران نیز اضطراب را کاهش داد، که نشان میدهد این مکانیزم ممکن است فراتر از مدل ژنتیکی Grik4 تعمیمپذیر باشد. لرما اشاره کرد: این امر اعتمادبهنفس میدهد که اصل مداری که کشف کردیم میتواند بهطور گستردهتری در تنظیم احساسات کاربرد داشته باشد.
با این حال، برخی کاستیها بازنشده باقی ماندند. حیوانات درمانشده هنوز در حافظهٔ شناسایی اشیاء (object recognition memory) دچار اختلال بودند؛ این امر نشان میدهد که علائم شناختی شامل نواحی دیگری مانند هیپوکامپ نیز میشوند. تیم پژوهشی محتاطانه این یافته را بهعنوان یک استراتژی هدفمند و نه یک درمان کامل چارچوببندی میکند: اصلاح یک میکرِدیوس مشخص در آمگدالا میتواند علائم عاطفی خاصی را کاهش دهد اما تمام پیامدهای رفتاری ناشی از تغییرات ژنتیکی زمینهای را پاک نمیکند. این نکته در طراحی مداخلات ترکیبی، که ممکن است نیاز به هدفگیری همزمان چند ناحیه و چند مولفه داشته باشند، اهمیت دارد.

پژوهشگران IN CSIC-UMH: Álvaro García، Juan Lerma، Ana Valero Paternain و María Isabel Aller.
چرا این یافته برای درمانهای آینده اهمیت دارد
این مطالعه چند ایدهٔ مرتبط با ترجمهٔ بالینی را برجسته میکند: اول، اینکه علائم عاطفی میتوانند از عدمتعادلهای محلی در برانگیختگی و اتصال سیناپسی ناشی شوند؛ دوم، اینکه اهداف مولکولی دقیق (مانند مسیرهای سیگنالدهی Grik4/GluK4) را میتوان در یک ناحیهٔ محدود مغز تنظیم کرد تا فایدهٔ رفتاری حاصل شود؛ و سوم، اینکه مداخلات در سطح مدار — خواه ژنتیکی، دارویی یا نئومدولاتوری — ممکن است جایگزینهای متمرکزتری نسبت به داروهای سیستمیک ارائه دهند. این نکات برای توسعه درمانهای مبتنی بر مدار عصبی، از جمله درمانهای ژنتیکی موضعی، شیمیژنتیک (chemogenetics)، اپتوژنتیک و تحریک عصبی هدفمند، اهمیت دارند.
در مسیر جلو، درمانهایی که از این کار الهام گرفتهاند میتوانند برای بازتوازن دینامیکهای برانگیختگی و بازداری در میکرِدیوسهای مشخص آمگدالا از سامانههای رسانش هدفمند یا روشهای تنظیم عصبی دقیق استفاده کنند. با این حال تبدیل کشفیات مدارهای موشی به درمانهای ایمن برای انسان مستلزم نقشهبرداری از سلولهای معادل در آمگدالای انسانی، آزمونهای ایمنی و اثربخشی گسترده، و توسعهٔ روشهای تحویل که استانداردهای بالینی را برآورده کنند، خواهد بود. چالشهای فنی شامل تحویل دقیق مولکولها یا ژندرمانی به زیرجمعیت سلولی مشخص، کنترل طولانیمدت بیان ژنی و جلوگیری از اثرات جانبی غیرمنتظره است.
نکاتی فنی و علمی برای محققان و توسعهدهندگان درمان
برای محققان حوزهٔ علوم اعصاب و توسعهدهندگان درمان، این مطالعه حاوی جزئیات فنی مهمی است که میتواند در طراحی مطالعات بعدی مورد استفاده قرار گیرد: اهمیت استفاده از مدلهای ژنتیکی مشخص برای تفکیک نقش رسیورهای خاص (مانند GluK4)، بهکارگیری وکتورهای ویروسی با قابلیت هدفگیری سلولمحور، ترکیب دادههای الکتروفیزیولوژیک با آزمونهای رفتاری و استفاده از مارکرهای فلورسنت و آنزیمی (GFP و CRE) برای ارزیابی کارایی تحویل مولکولی. همچنین تجزیه و تحلیل نسبت تحریککننده/مهاری در سطح سیناپسی و شبکهای میتواند متر بهتری برای اثرات بالینی بالقوه ارائه دهد تا تنها تغییرات رفتاری کوتاهمدت.
از منظر ترجمهٔ فاز بالینی، دستهای از روشها میتوانند از این دیدگاه سود ببرند: تحویل موضعی ژندرمانی یا RNAمداخلهگر برای تنظیم بیان پروتئینهای هدف، داروهای مولکولی کوچک یا آنتاگونیستهایی که عملکرد گیرندههای GluK4 را تعدیل میکنند، و رویکردهای neuromodulation نظیر تحریک مغزی عمقی (DBS) با پارامترهای تنظیمشده برای بازیابی نسبت برانگیختگی-بازداری. ترکیب این رویکردها با نشانگرهای زیستی و تصویرسازی پیشرفته میتواند مسیرهایی برای آزمون در مدلهای بزرگتر و در نهایت کارآزماییهای بالینی پدید آورد.
دیدگاه کارشناس
دکتر Elena Ruiz، عصبپزشک بالینی که در این مطالعه مشارکت نداشت، اظهار داشت: این پژوهش هیجانانگیز است زیرا ژنتیک مولکولی را به فیزیولوژی مدار و رفتار در یک زنجیرهٔ علّی پیوند میدهد. او افزود: این کار وعدهٔ یک درمان فوری را نمیدهد، اما نشان میدهد که اصلاحهای بسیار مشخص مداری میتواند تأثیرات رفتاری بزرگی داشته باشد — این همان وضوح مکانیکی است که برای طراحی درمانهای نسل بعد نیاز داریم. نظر او همچنین بر لزوم مطالعات طولی و بررسی پیامدهای بلندمدت مداخلات مدارمحور تأکید میکند.
در پایان، این مطالعه الگویی روشنی ارائه میدهد مبنی بر اینکه چگونه تمرکز بر زیرجمعیتهای نرونی در ساختارهایی مانند آمگدالا میتواند برداشت جدیدی از علتشناسی اختلالات عاطفی فراهم آورد و راه را برای رویکردهای درمانی هدفمندتر و کمخطرتر باز کند. همزمان باید به محدودیتها و نیاز به مطالعات تکمیلی در مدلهای مختلف، بررسی ایمنی و درک بهتر نقش نواحی شناختی مانند هیپوکامپ در علائم شناختی توجه داشت. پیشرفت در این حوزه نیازمند همکاری میان علوم پایه، مهندسی مولکولی، تصویرسازی عصبی و بالین خواهد بود.
منبع: scitechdaily
نظرات
مهدی
خیلی رویاپردازی نکنیم، مدل موش محدودیت داره و نشون میده راه طولانیه. نترسونن مردم با وعدههای زود، مطالعات طولی لازمه
سفرون
دیدگاه منطقیه؛ نشون میده باید سلولمحور و منطقهمحور فکر کنیم. البته کلی مسیر تا درمان عملی مونده.
لابکور
تو آزمایشگاه خودمون هم دیدم که تغییرات اندک در مدار میتونه رفتار رو جابجا کنه ولی انسان پیچیدهتره، هیپوکامپ و چیزای دیگه هم حساب دارن
توربومک
اینو روی آدم چطور پیاده کنن؟ ایمنه؟ کنترل بلندمدت چطور تضمین میشه، کلی سوال بیجواب…
کوینپایل
منطقش رو میفهمم، هدفگیری مدار بهتر از داروهای سراسریه اما ترجمه به انسان خیلی سختتره
دیتاپالس
وای، یعنی چند تا نورون رو درست کنی اضطراب محو میشه؟ اینقدر دقیق؟ اگر واقعیه خیلی بزرگه… ترسناک و امیدوارکننده همزمان.

ارسال نظر