12 دقیقه
کشفی که در سال ۲۰۲۵ جایزه نوبل فیزیولوژی یا پزشکی را به خود اختصاص داد، پاسخی به یکی از پرسشهای بنیادی در ایمنیشناسی بود: چگونه بدن از حمله دستگاه ایمنی به بافتهای خودش جلوگیری میکند؟ سه دانشمند—شیمون ساکاگوچی از دانشگاه اوزاکا، مری ای. برونکو از موسسه سیستمهای زیستی و فرد رمزدل از سونوما بیوتراپوتیکس—نشان دادند که یک زیرمجموعه ویژه از لنفوسیتهای T، معروف به سلولهای تنظیمکننده T (T-reg)، نقش نگهبانان امنیتی را ایفا میکنند و واکنشهای ایمنی مخرب را مهار میکنند.
چرا این کشف مهم است؛ یک پارادوکس حلشده در ایمنیشناسی
یک دستگاه ایمنی موثر باید بین پاتوژنها و بافتهای سالم تمایز قائل شود: از یکسو میکروبها و سلولهای آسیبدیده را حذف کند و از سوی دیگر از حمله به بافت سالم جلوگیری نماید. برای دههها تصور میشد که حذف اولیه سلولهای خودواکنش در تیموس (thymus) کفایت میکند تا «تحمل مرکزی» (central tolerance) برقرار شود و بیشتر بیماریهای خودایمنی رخ ندهد. اما شواهدی از دهههای ۱۹۸۰ و ۱۹۹۰ حکایت از وجود لایهای دیگر از کنترل داشت: سلولهایی که در محیط پیرامونی (periphery) به طور فعال پاسخهای ایمنی را سرکوب میکنند.
ساکاگوچی با آزمایشهایی که در جمعیت موشها انجام داد، این دیدگاه سنتی را به چالش کشید. زمانی که تیموس از موشهای تازهمتولد حذف و سپس سلولهای T به حیوانات همژن منتقل شد، بهجای ضعف ایمنی مورد انتظار، برخی موشها علائم خودایمنی بروز دادند و مشاهدات نشان داد که جمعیتی مجزا از سلولهای T وجود دارد که از بروز واکنشهای ایمنی بیرویه جلوگیری میکند. در سال ۱۹۹۵ ساکاگوچی و همکارانش این جمعیت را «سلولهای تنظیمکننده T» نامیدند و مسیر تازهای در فهم تحمل ایمنی گشودند.
مکانیک عملکرد سلولهای تنظیمکننده T
تحقیقات بعدی که توسط برونکو و رمزدل تکمیل شد، سازوکارهایی را مشخص کرد که از طریق آنها T-regها التهاب را کنترل میکنند. این سلولها از چند مسیر همزمان برای مهار پاسخ ایمنی استفاده میکنند: ترشح سیتوکینهای ضدالتهابی، مصرف فاکتورهای رشد مورد نیاز سلولهای اثرگذار (effector T) تا آنها را از تکثیر باز دارند، و انتقال سیگنالهای مهاری مستقیم از طریق تماس سلول-سلول. نکتهٔ کلیدی در این مسیر کشف یک فاکتور رونویسی به نام FoxP3 بود که بهعنوان نشانگر مولکولی و تنظیمکنندهٔ اصلی توسعه و عملکرد T-regها شناخته شد.
نشانهها و مسیرهای کلیدی
- FoxP3: فاکتور رونویسی تعیینکنندهٔ توسعه و پایداری سلولهای تنظیمکننده T.
- سیتوکینهای ضدالتهابی: ترشح IL-10 و TGF-β که محیط التهابی را کاهش میدهند.
- مهار از طریق تماس مستقیم: استفاده از مولکولهای سطحی برای کنترل سلولهای ارائهدهندهٔ آنتیژن و سلولهای اثرگذار.
- رقابت برای منابع تغذیهای: مصرف IL-2 توسط T-regها که منابع را از سلولهای اثرگذار میگیرد و تکثیر آنها را کاهش میدهد.
این مکانیسمهای موازی به T-regها امکان میدهد تا هم پاسخهای ایمنی را فشرده کنند و هم در مواقعی که لازم است تحمل اختصاصی نسبت به آنتیژنها (مثلاً در پیوند اندام یا در مواجهه طولانیمدت با میکروبیوتا) برقرار بماند.
شواهد آزمایشگاهی و مدلهای حیوانی: چگونه کشف رخ داد
مطالعات اولیه ساکاگوچی و همکاران شامل انتقالهای پیوندی و حذف گروهی از سلولها در موشها بود. این روشها نشان داد که حتی وقتی تیموس حذف یا عملکرد آن تغییر کند، وجود یا عدم وجود یک زیرمجموعه از سلولهای T میتواند تعیینکننده پیشرفت بیماری خودایمنی باشد. بهعبارت دیگر، تحمل تنها نتیجه حذف مرکزی نبود؛ یک مهار فعال در محیط پیرامونی نیز لازم بود.
پس از توصیف اولیه، پژوهشهای مولکولی و ژنتیکی ساختارهای مولکولی نشانگر را آشکار کردند. جهشهای طبیعی یا القایی در ژن FoxP3 در مدلهای حیوانی منجر به سندرمهای التهابی و خودایمنی شدید میشد که اهمیت این ژن را در کارکرد T-regها تایید میکرد. این گونه شواهد سبب شد محققان بتوانند روشهای جداسازی، شناسایی و مطالعهٔ T-regها را توسعه دهند و آنها را در شرایط بالینی بهتر بررسی کنند.
تصاویر و تکنیکها
تکنیکهای میکروسکوپی (از جمله میکروسکوپ الکترونی و تصویربرداری فلورسانس) تعامل T-regها با سلولهای ارائهدهندهٔ آنتیژن را در سطح سلولی نشان دادهاند. این تصاویر کمک کردند تا شبکهٔ پیچیدهٔ ارتباطات سلولی و نقاط تماس مستقیم که برای انتقال سیگنالهای مهاری لازم است، بهتر درک شود.
پیامدهای بالینی: چهار حوزهٔ اصلی
کشف سلولهای تنظیمکننده T دید ما را نسبت به بیماریها و درمانها تغییر داد. این تغییر نگرش از مدل منفعلِ حذف خودواکنش به مدل فعالِ تنظیم، پیامدهای گستردهای در حوزههای مختلف پزشکی داشته است:
- بیماریهای خودایمنی: کاهش یا نقص عملکرد T-regها بهعنوان عامل زیربنایی در بیماریهایی مانند دیابت نوع ۱، آرتریت روماتوئید و مولتیپل اسکلروزیس مطرح شده است. استراتژیهای درمانی جدید بهدنبال بازیابی یا شبیهسازی عملکرد تنظیمکنندهها هستند تا التهاب مزمن را کنترل کنند.
- پیوند اعضا: افزایش تعداد یا توانایی T-regها میتواند موجب کاهش رد پیوند شود و نیاز به داروهای سرکوبگر ایمنی سیستمیک و طولانیمدت را کاهش دهد. پژوهشها روی انتقال سلولهای T-reg اختصاصی آنتیژن و تولید آنها در آزمایشگاه ادامه دارد.
- ایمونوتراپی سرطان: در تومورها، T-regها اغلب با مهار پاسخ ایمنی علیه سلولهای سرطانی موجب شکست درمان ایمنی میشوند. تنظیم یا کاهش فعالیت T-regها در بافت توموری میتواند اثربخشی ایمنوتراپیها را افزایش دهد؛ اما در عین حال باید از بروز عوارض خودایمنی جلوگیری کرد.
- واکسنها و عفونتها: T-regها نقش مهمی در شکلدهی پاسخ به واکسن و تنظیم فعالیت ایمنی در طول و پس از عفونت دارند. در طراحی واکسنها و استراتژیهای درمانیِ عفونی، موازنه بین تحریک ایمنی کافی و کنترل التهابِ بیش از حد اهمیت دارد.
بههمین دلیل، زیستفناوریها و شرکتهای دارویی سرمایهگذاری گستردهای بر روی درمانهای مبتنی بر T-reg گذاشتهاند: از توسعه داروهایی که فعالیت FoxP3 را تقویت یا تثبیت میکنند تا تولید سلولهای مهندسیشده مثل CAR-T-reg که هدفمندتر و امنتر عمل میکنند.
جنبههای فنی و چالشها در بهرهبرداری بالینی
با وجود هیجان بالینی، تبدیل این کشف به درمانهای پایدار چندین چالش فنی و علمی دارد. نخست، پایداری و اختصاصی بودن T-regها در محیط بالینی یکی از مسائل کلیدی است: چگونه سلولهایی بسازیم که طول عمر کافی، ثبات فنوتیپی و اختصاصی بودن آنتیژنی مناسب داشته باشند؟ دوم، چگونه از تبدیل احتمالی این سلولها به سلولهای التهابی یا از دست رفتن عملکرد FoxP3 جلوگیری کنیم؟
روشهای تولید شامل جداسازی از خون خود بیمار، تکثیر در شرایط آزمایشگاهی و در برخی موارد دستکاری ژنتیکی برای افزایش اختصاصیبودن یا پایداری است. هر یک از این مراحل نیازمند ارزیابیهای دقیق ایمنی، ردیابی درونبدنی و استانداردسازی فرایند است تا اطمینان حاصل شود که درمانها قابل تکرار و امن هستند.
نمونههایی از رویکردهای تجربی
- گسترش آنتیژن-خاص T-regها در شرایط درونآزمایشی برای هدفگیری یک پاسخ ایمنی خودواکنش مشخص.
- مهندسی ژنتیکی برای القای بیان FoxP3 یا مولکولهای مهاری دیگر در سلولهای T معمولی تا آنها را به T-reg مشابه تبدیل کنند.
- استفاده از نانوذرات یا مولکولهای کوچک برای القای محیط موضعی tolerogenic در بافت پیوندی یا تومور.
هر یک از این رویکردها مزایا و محدودیتهای خاص خود را دارند و مطالعات بالینی در حال بررسی اثربخشی و ایمنی آنها در بیماریهای مختلف است.
آیندهٔ پژوهش: از مولکول تا میکروبیوم
خطوط تحقیقاتی که در آینده احتمالاً رشد خواهند کرد شامل افزایش دقیق جمعیتهای T-reg آنتیژن-اختصاصی، طراحی مولکولهای کوچک که فعالیت FoxP3 را تعدیل میکنند، و ترکیب درمانهای مبتنی بر T-reg با فنآوریهای مهندسی سلولی مانند CAR-T-reg. علاوه بر این، تعاملات محیطی—از جمله نقش میکروبیوم روده در شکلگیری و پایداری T-regها—بهعنوان یک حوزهٔ مهم مورد توجه است.
محققان دریافتند که برخی باکتریهای روده میتوانند توسعه T-regهای دارای مشخصهٔ خاص را تقویت کنند و بدین ترتیب تعادل سیستم ایمنی را به نفع تحمل سوق دهند. این یافتهها باعث شده است تا ایدهٔ درمانهای ترکیبیِ پروبیوتیک/سلولی مطرح شود که میتوانند بهطور همزمان محیط مناسبی برای عملکرد T-regها فراهم آورند و جمعیت آنها را تقویت کنند.
سؤالات باز و نیاز به شواهد بیشتر
- چگونه میتوان T-regهای آنتیژن-اختصاصی را در اندازههای بالینی با هزینه منطقی تولید کرد؟
- چه روشهایی بهترین تعادل بین اثربخشی ضدالتهابی و جلوگیری از عوارض خودایمنی را ارائه میدهند؟
- نقش محیطی و اپیژنتیک در ثبات FoxP3 و عملکرد T-regها تا چه اندازه تعیینکننده است؟
پاسخ به این پرسشها نیازمند همکاریهای بینرشتهای میان ایمونولوژیستها، ژنتیکدانان، بیوانفورماتیکها و شرکتهای تجاری است تا از کشف تا کاربرد بالینی مسیر موثری طی شود.
نگاهی دقیقتر به FoxP3: علامتگذاری، عملکرد و مهندسی
FoxP3 از دیدگاه مولکولی بهعنوان هستهٔ شبکهٔ تنظیمکنندهٔ ژنی عمل میکند که برنامهٔ تمایز و عملکرد T-regها را تعیین مینماید. روشهای شناسایی T-regها در آزمایشگاه غالباً بر پایهٔ سطوح بالای بیان FoxP3 همراه با پروفایل سطحی مولکولی مشخص (مانند CD25 بالا و CD127 پایین) است. اگرچه FoxP3 نشانگر قابل اتکایی است، اما درک کامل مدارهای تنظیمی که آن را کنترل میکنند برای طراحی مداخلات درمانی ضروری است.
در مهندسی سلولی، محققان دو رویکرد کلی را دنبال میکنند: القای FoxP3 در سلولهای T معمولی یا اصلاح مستقیم T-regها برای افزایش ویژگیهای مطلوب مانند پایداری و هدفگیری. همچنین پژوهشها روی مولکولهای کوچکی که پایداری FoxP3 را افزایش دهند یا از تخریب آن جلوگیری کنند، ادامه دارد؛ این مولکولها ممکن است بهعنوان داروهای جایگزین برای زمانی که تولید یا انتقال سلولی عملی یا مقرون به صرفه نیست، مفید باشند.
دیدگاه متخصصان و پیامی برای پژوهشگران
دکتر النا مارتینز، ایمونولوژیست و فعال ارتباط علمی، میگوید: «شناسایی سلولهای تنظیمکننده T نحوهٔ تفکر ما دربارهٔ تعادل ایمنی را بازتعریف کرد. بهجای تمرکز صرف بر حذف سلولهای مضر، اکنون به مهندسی راهحلهای ایجادکنندهٔ تحمل میاندیشیم—راهحلهایی که میتوانند در بیماریهای خودایمنی تحمل را بازسازی کنند یا در سرطان ترمزهای ایمنی را بازنمایند. جایزهٔ نوبل تاییدی بر اثرات گسترده و بالینی این اکتشاف است.»
این نکته نشان میدهد که کشف T-regها فقط یک پیشرفت نظری نبود؛ بلکه دریچهای برای کاربردهای بالینی باز کرد که میتواند طیف گستردهای از بیماریها را متحول سازد. پژوهشگرانِ نسل بعد با بهرهگیری از ابزارهای جدید ژنومی، ویرایش ژن و مهندسی سلولی در موقعیتی مناسب برای ترجمهٔ این ایدهها به درمانهای واقعی قرار دارند.
در عمل، تمرکز بر توسعه بیومارکرهای بالینی برای شناسایی بیماران مستعد پاسخ به درمانهای مبتنی بر T-reg و ایجاد پروتکلهای نظارتی برای پایش عملکرد و ایمنی، از اولویتهای کوتاهمدت در این حوزه است.
چه چیزی این مطلب را برای خوانندهٔ غیرمتخصص معنیدار میکند؟
تصور کنید دستگاه ایمنی مانند یک تیم امنیتی عمل میکند؛ نه تنها باید متجاوزان را شناسایی کند، بلکه باید از آسیب به شهروندان بیگناه هم جلوگیری کند. سلولهای تنظیمکننده T درست مانند افسران میانی در این تیماند که از اقدامات بیشازحد ضربهزننده جلوگیری میکنند. اکنون که میدانیم این افسران چه ظاهری دارند و چگونه کار میکنند، میتوانیم دربارهٔ اینکه چگونه آنها را تقویت یا کنترل کنیم تصمیمهای آگاهانهتری بگیریم—چه برای درمان بیماریهای خودایمنی و چه برای تقویت مبارزه بدن با سرطان.
برای بیماران و خانوادهها، این بدان معناست که مسیرهای درمانی جدیدی در افق قرار دارد؛ درمانهایی که ممکن است کمتر عوارض جانبی مستقیمِ سرکوب ایمنی داشته باشند و در عین حال دقیقتر و هدفمندتر باشند. برای پزشکان، این کشف امکاناتی برای شخصیسازی درمان و کاهش نیاز به مصرف طولانیمدتِ داروهای سرکوبگر را فراهم میکند.
در نهایت، جایزهٔ نوبل ۲۰۲۵ برای کار بر روی سلولهای تنظیمکننده نشان میدهد که علم پایه و تحقیقات کنجکاوانه میتواند بهسرعت مسیر درمانها را تغییر دهد و چشمانداز پزشکی را متحول نماید.
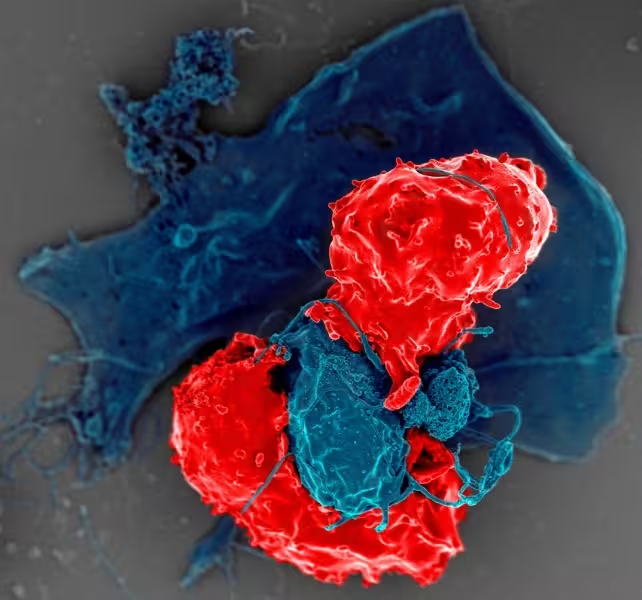
تصویر میکروسکوپ الکترونی از سلولهای تنظیمکننده T (قرمز) در تعامل با سلولهای ارائهدهندهٔ آنتیژن (آبی). (National Institute of Allergy and Infectious Diseases/NIH/Flickr)
در آستانهٔ رشد بالینی، پژوهشهای آینده به دنبال افزودن دقت، پایداری و ایمنی به درمانهای مبتنی بر T-reg هستند—و این مسیر ترکیبی از دانش بنیادی و نوآوری بالینی را میطلبد.
منبع: sciencealert

ارسال نظر